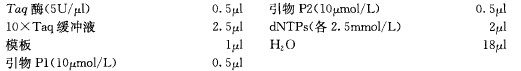融合 PCR
简介
融合 PCR 是通过 PCR 的方法,将两段 DNA 序列连接到一起,处于相邻位置。一般来说,融合 PCR 设计的引物序列的 5' 端和 3' 端各包含一段待融合的模板序列,这条引物相当于衔接头,将两段 DNA 序列连接到一起。
融合 PCR 技术最常用于全长序列的拼接,现在随着技术的发展,逐步应用于基因的破坏、基因的标记、序列缺失、两种基因的融合等领域。
原理
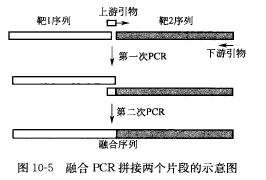
融合 PCR 实验的基本原理是通过在上游引物的 5' 端添加一段帽子序列,这段帽子序列与靶 1 序列同源;而此引物的 3' 端序列与靶 2 序列同源。这样,在第一个 PCR 反应中,以靶 2 序列为模板,使靶 2 序列得到扩增,而扩增产物均携带与靶 1 序列同源或互补的序列。然后,以这样的扩增产物为引物,在第二个 PCR 反应中,以靶 1 序列为模板,使靶 1 序列得到扩增。这样得到的产物既含有靶 1 序列,又含有靶 2 序列,成为一段长片段的融合序列(见图 10-5)
材料与仪器
器材:PCR 仪、电泳仪等。
步骤
融合 PCR 实验的基本过程可分为如下几步,应用于基因插入的融合 PCR 的具体操作步骤,融合 PCR 过程如图 10-6 所示:

(A)用标准的 PCR 方法,进行 3 个独立的 PCR 反应:
PCR 反应 1:获得一个标签序列:采用引物 tag-F 和 Wg-R。
PCR 反应 2:获得目的基因起始密码子 ATG 的上游序列,约 500 bp,采用的引物为 up-F 和 up-R,其中 up-R 含 24 bp 的序列与标签序列的 5' 互补。
PCR 反应 3:获得目的基因起始密码子 ATG 及其下游序列,约 500 bp,釆用的引物为 do-F 和 do-R,其中 do_F 含 24 bp 序列与标签序列的 3' 互补。
(B)融合 PCR 反应反应体系:3 种 PCR 产物按照大致相同的摩尔比混合(PCR 产物最好先分别纯化),总量约 100 ng,然后配成 50 μL 的反应体系,包括 5 μL 含 MgSO4 的 Pwo 聚合酶缓冲液、各 0.2 mmol/L 的 dNTP,补加去离子水至 49 μL,将此反应体系加热到 94 ℃ 后,补加 1 μL Pwo 聚合酶(Roche)。
反应条件:94 ℃ 30 s-55 ℃ 1 min-72 ℃ 3.5 min,共进行 5 个循环。目的是使 3 种 PCR 产物互补延伸,最终形成全长的融合 PCR 产物。
(C)融合 PCR 产物的进一步扩增上面的 5 个循环做完以后,反应体系加热到 94 ℃,另加入 50 μL 反应溶液(5 μL 含 MgSO4 的 Fwo 聚合酶缓冲液,各 0.2 mmol/L 的 dNTP,1 μL Pwo 聚合酶,以及 5' 和 3' 端最末端的引物 up- F 和 dbR,去离子水补足额定体积以 94 ℃ 30 s—55 ℃ 1 min—72 ℃ 3.5 min 为 PCR 反应条件,共进行 25 个循环。得到的融合 PCR 产物包含起始密码子 ATG 上游 500 bp 的序列,标签序列,以及起始密码子 ATG 及其下游 500 bp 的序列。
注意事项
1、同源互补区域的长度
由于融合 PCR 主要是利用两个片段 3' 端的互补序列进行融合,所以待融合的片段越长,完整的融合产物的量越少。有时扩增产物在凝胶电泳中难以检测。但将待融合的两个片段之间的同源互补区延长是增加融合物产量的一个好办法。如图 10-12 中操作流程(b)所示容易获得高产量,而操作流程(a)得到的产物量少卬七范宝昌等为了获得登革 2 型病毒的全长 cDNA 分子,将 5' 半分子和 3' 半分子的互补序列长度增加到 1.6 kb,保证了半分子退火后的正确匹配和中间体的稳定

2、DNA 聚合酶的性能
融合 PCR 结果有时不理想,也与采用的 DNA 聚合酶的性能有关。在绝大多数情况下,推荐使用高保真的 DNA 聚合酶,以最大限度减少突变的产生。但保真性能好,扩增能力就有一定的局限,比如范宝昌等为了保证 11 kb 融合产物的获得,采用的是具有较好扩增能力,但保真度略低于 Pfu 的高保真 PCR 系统(B.M. 公司)。Wang 等的实验结果证明,如果高保真的 DNA 聚合酶的融合扩增效果不好,可以尝试利用普通 Taq 酶和高保真的 DNA 聚合酶混合使用。因为有的高保真 DNA 聚合酶对从琼脂糖凝胶和电泳缓冲液来源的模板比较敏感,不易获得好的扩增效果。
3、PCR 引物的设计和 PCR 反应条件
Oakley 实验室在进行如图 10-13 的融合 PCR 时,发现引物 P2 和 P5 距各自融合端衔接头的最佳距离为 1 000 bp 左右,至于 P2、P5 以及待融合片段的重叠区域的长度都仅有 18~21 bp。另外,他们为了保证在不同的 PCR 仪器上做出相同的 PCR 结果,他们规定了如下精细的 PCR 条件:
① 94 ℃,2 min;
② 10 个循环:94 ℃ 20 s,70 ℃ 1 s,以 0.1 ℃/s 的速度降到 55 ℃,55 ℃ 30 s,以 0.2 ℃/s 升温 到 68 ℃ ,68 ℃ 5 min;
③ 5 个循环:94 ℃ 20 s,70 ℃ Is,以 0.1 ℃/s 的速度降到 55 ℃, 55 ℃ 30 s,以 0. 2 ℃/s 升温到 68 ℃,68 ℃ 5 min(以后每个循环加 5 s,最后一个循环延伸时间为 5 min 20 s);
④ 10 个循环:94 ℃ 20 s,70 ℃ 1 s,以 0.1 ℃/s 的速度降到 55 ℃,55 ℃ 30 s,以 0.2 ℃/s 升温 到 68 ℃,68 ℃ 5 min 20 s(以后每个循环加 20 s,最后一个循环延伸时间为 9 min 20 s);
在步骤 ③ 和 ④ 中,延伸时间的延长是考虑到 Taq 酶的活力在逐步减弱。经过他们的严格而精细的 PCR 程序设定,得到了单一而高浓度的特异性产物。


相关文章
- PCR-SSCP的发展现状
- PCR-SSCP注意的事项
- PCR-SSCP原理和操作步骤
- 内切酶在PCR反应产物中的活性(Activity of Restriction Enzymes in a Primer Extensio
- RT-PCR Analysis--详细的RT-PCR方法
- RT-PCR: The Basics
- Real-Time or Kinetic PCR
- PCR Amplification from Microbial Colonies
- Calculating Concentrations for PCR
- PURIFICATION OF PCR PRODUCTS WITH SEPHAD