变性凝胶电泳实验基本方案
材料与仪器DNA乙醇 异丙醇 二甲基二氯硅烷 TEMED 变性丙烯酰胺溶液 SDS电泳仪 注射器 巴斯德吸管 干胶机步骤1. 制作每块凝胶时,首先要用肥皂及水
材料与仪器
DNA
乙醇 异丙醇 二甲基二氯硅烷 TEMED 变性丙烯酰胺溶液 SDS
电泳仪 注射器 巴斯德吸管 干胶机
乙醇 异丙醇 二甲基二氯硅烷 TEMED 变性丙烯酰胺溶液 SDS
电泳仪 注射器 巴斯德吸管 干胶机
步骤
1. 制作每块凝胶时,首先要用肥皂及水小心严格地清洗两块30 cm×40 cm的前后玻璃平板,用去离子水冲洗后晾干,用喷射洗瓶喷10%乙酵或异丙醇使平板湿海。
2. 然后用Kimwipe纸或其他无绒纸巾将平板擦干。
3. 戴手套在通风橱工作,用浸湿了含5%二甲基二氯硅烷的氯仿溶液的Kimwipe纸在每片平板的其中一面加一层此溶液,并小心洗擦拭整面平板。
4. 待硅化层干后,用Kimwipe纸以70%乙醇或异丙醇擦净并干燥,最后再检查平板有没有灰尘或其他物质。
2. 然后用Kimwipe纸或其他无绒纸巾将平板擦干。
3. 戴手套在通风橱工作,用浸湿了含5%二甲基二氯硅烷的氯仿溶液的Kimwipe纸在每片平板的其中一面加一层此溶液,并小心洗擦拭整面平板。
4. 待硅化层干后,用Kimwipe纸以70%乙醇或异丙醇擦净并干燥,最后再检查平板有没有灰尘或其他物质。
5. 按厂商指南用0.2~0.4 mm 均厚的垫片和大的书本装订夹子组装凝胶胶模夹层,注意垫片与平板的边、底压紧对齐。
6. 制作每块凝胶时,在100 ml 烧杯配制60 ml 所需的变性丙烯酰胺凝胶溶液,在灌胶(步骤7)前,彻底混匀60 μl TEMED和0.6 ml 10%过硫酸铵于每份丙烯酰胺溶液中。
6. 制作每块凝胶时,在100 ml 烧杯配制60 ml 所需的变性丙烯酰胺凝胶溶液,在灌胶(步骤7)前,彻底混匀60 μl TEMED和0.6 ml 10%过硫酸铵于每份丙烯酰胺溶液中。
7. 立即灌胶,用60 ml 注射器小心吸出丙烯酰胺溶液,避免吸入气泡,让短平板朝上, 并使凝胶平板夹层与臬面成45度角,沿着平板的一边慢慢将丙烯酰胺溶液推入两片平板之间,其间可调整角度让胶液慢馒流入夹层的一边。
8. 当溶液达到短平板的顶部时,放下胶模夹层至其顶部边缘离操作台平面仍有5 cm 左右,其下垫一空的吸头盒或其他物件以使之保持较低的角度。
9. 将0.2~0.4 mm 厚的鲨鱼齿样品梳的平齐一侧插入胶液中,至短平板下约2~3 mm,操作须十分小心以避免产生气泡,用一个书本装订夹将平极之间的样品梳夹紧,以避免在掩子与平板间形 成凝胶固块。
10. 加一层过量的丙烯酰胺溶液至梳子,保证其被完全覆盖。用水冲洗注射器,除去过量的丙烯酰胺。
11. 除去每片胶模夹层的底部垫片或胶带,用刀片除去样品瓶周围的过量聚丙烯酰胺凝胶。
12. 用水清洗平板表面溢出的尿素和丙烯酰胺溶液,从每片胶模夹层中拨去鲨鱼齿样品梳,避免拉伤凝胶顶部。
13. 用水清洗梳子,准备好在步骤16操作时重新插回样品孔。如果用常规样品梳,小心防止撕裂聚丙烯酰胺加样孔,
8. 当溶液达到短平板的顶部时,放下胶模夹层至其顶部边缘离操作台平面仍有5 cm 左右,其下垫一空的吸头盒或其他物件以使之保持较低的角度。
9. 将0.2~0.4 mm 厚的鲨鱼齿样品梳的平齐一侧插入胶液中,至短平板下约2~3 mm,操作须十分小心以避免产生气泡,用一个书本装订夹将平极之间的样品梳夹紧,以避免在掩子与平板间形 成凝胶固块。
10. 加一层过量的丙烯酰胺溶液至梳子,保证其被完全覆盖。用水冲洗注射器,除去过量的丙烯酰胺。
11. 除去每片胶模夹层的底部垫片或胶带,用刀片除去样品瓶周围的过量聚丙烯酰胺凝胶。
12. 用水清洗平板表面溢出的尿素和丙烯酰胺溶液,从每片胶模夹层中拨去鲨鱼齿样品梳,避免拉伤凝胶顶部。
13. 用水清洗梳子,准备好在步骤16操作时重新插回样品孔。如果用常规样品梳,小心防止撕裂聚丙烯酰胺加样孔,
14. 凝胶电泳装置的下层贮液槽加入1XTBE缓冲液,使凝胶夹层能浸泡在2~3 cm 的一层缓冲液中,放入凝胶夹层并用夹子固定在电泳装置上。
15. 上层贮槽倒入1×TBE缓冲液,使超过凝胶顶部约3 cm,用巴斯德吸管或Beral细管以1×TBE清洗凝胶顶部。
15. 上层贮槽倒入1×TBE缓冲液,使超过凝胶顶部约3 cm,用巴斯德吸管或Beral细管以1×TBE清洗凝胶顶部。
16. 将清洗干净的鲨鱼齿样品梳重新播回凝胶夹层,使其齿部仅可触及凝胶,用巴斯德吸管或Beral细管以1×TBE缓冲液彻底清洗加样孔,以除去零星的聚丙烯酰胺碎片。
17. 加样前,在45 V/cm 凝胶的电压降下预电泳,使凝胶预热,即在1 700 V,70 W 恒功率下电泳约30 min。
18. 在加样前,清洗加样孔除去浸进孔中的尿素。
18. 在加样前,清洗加样孔除去浸进孔中的尿素。
19. 在甲酰胺/染料溶液中的样品,盖好盖子,在95℃加热2 min,然后置于冰上,每孔加 样2~3 μl 测序用的加样吸头可于每次加样后在下槽缓冲液中冲洗2次后继续使用。
20. 在45~70 W 恒功率下电泳,凝胶温度保持在约65℃。
21. 高于此温度可能会造成玻璃平板炸裂或条带弥散,而太低温度可使测序产物不完全变性、现察标志染料的迁移以确定电泳时间。
22. 将干冰加入干胶机的冷阱并预热至80℃。
23. 电泳完毕时,排出上下液槽的缓冲液,并按放射性废物处理丢弃液体。
24. 从电泳装置中取出凝胶夹层,并在冷自来水下冲洗直至两面玻璃平板表面都冷却为止,将夹层平放在纸巾上,四口玻璃平板(短平板)朝上,除去多余的液体及夹子、胶带,取出一边的垫片。
25. 两片玻璃平板之间插入一个长金属铲子,轻轻转动铲于将玻璃 平板橇起使之分开,凝胶应贴在下面的玻璃平板,如果贴在上面的平板,则将它翻转过来。
26. 从插有铲子的一边馒慢提起上面的平板,遂渐增加角度直至上层平板完全与凝胶分离。
20. 在45~70 W 恒功率下电泳,凝胶温度保持在约65℃。
21. 高于此温度可能会造成玻璃平板炸裂或条带弥散,而太低温度可使测序产物不完全变性、现察标志染料的迁移以确定电泳时间。
22. 将干冰加入干胶机的冷阱并预热至80℃。
23. 电泳完毕时,排出上下液槽的缓冲液,并按放射性废物处理丢弃液体。
24. 从电泳装置中取出凝胶夹层,并在冷自来水下冲洗直至两面玻璃平板表面都冷却为止,将夹层平放在纸巾上,四口玻璃平板(短平板)朝上,除去多余的液体及夹子、胶带,取出一边的垫片。
25. 两片玻璃平板之间插入一个长金属铲子,轻轻转动铲于将玻璃 平板橇起使之分开,凝胶应贴在下面的玻璃平板,如果贴在上面的平板,则将它翻转过来。
26. 从插有铲子的一边馒慢提起上面的平板,遂渐增加角度直至上层平板完全与凝胶分离。
27. 一旦平板分离后,取去另一边的垫片及除去凝胶周围多余的聚丙烯酰胺碎片。
28. 如果样品含32P或33P,固定步骤可用可不用。如果样品含33S,直接将凝胶连同玻璃平板一起放入浅托盘中,轻轻覆盖一层约2 cm 的5%乙酸 / 5%甲醇固定液,浸泡10~15 min,不时轻轻摇动托盘使凝胶与玻璃平板松开。
29. 将疑胶重新置于平板上,靠吸力或重力除去固定液注意保持凝胶处于平极的中央, 小心从托盘中将平板连同凝胶取出,放在工作平台上。
30. 将两张干的转印纸,叠齐如 同一张一祥,从凝胶的一端开始缓慢地向另一端放下,贴在凝胶的表面,小心防止在纸和凝胶间形成气泡。
31. 从平板上剥起转印纸,凝胶应和它一起被揭起,逐渐卷起纸,而凝胶就同它一起被剥离平板。
32. 将滤纸和凝胶放在预热的干胶机中,上面覆盖一张保鲜瞑,80℃处理20 min ~1 h,使凝胶彻底干燥。
30. 将两张干的转印纸,叠齐如 同一张一祥,从凝胶的一端开始缓慢地向另一端放下,贴在凝胶的表面,小心防止在纸和凝胶间形成气泡。
31. 从平板上剥起转印纸,凝胶应和它一起被揭起,逐渐卷起纸,而凝胶就同它一起被剥离平板。
32. 将滤纸和凝胶放在预热的干胶机中,上面覆盖一张保鲜瞑,80℃处理20 min ~1 h,使凝胶彻底干燥。
33. 从干胶上揭去保鲜膜,将干胶放在X光曝光盒中,Kodak XAR-5X光胶片直接与凝胶接触,室温放射自显影,经足够时间曝光后(一般需过夜)取出X光胶片并冲印。
常见问题
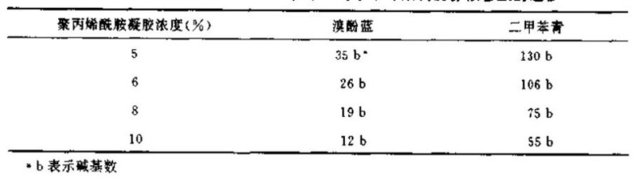
变性聚丙烯酰胺凝胶中相对于示踪染料的寡核苷酸的迁移