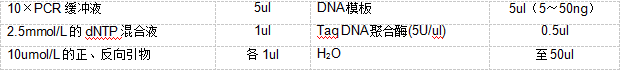序列特异性引物 PCR
简介
序列特异性引物 PCR,英文名是 sequence specific primer, PCR-SSP,借助 PCR 技术获得 HLA 型别特异的扩增产物,可通过电泳直接分析带型决定 HLA 型别,从而大大简化了实验步骤,具有简单易行的优点,分辨率可从低到高,成本低,在 HLA 分型中得到了广泛应用。
原理
PCR-SSP 分型方法使用的特异性引物与模版 DNA 完全互补,而且使用的 Taq 任聚合酶没有核酸外切酶的活性,因此不像通常 PCR 扩增时允许 3' 末端可以有一个或几个碱基错配,即使特异性引物发生非特异性退火,也不至于发生非特异性扩增。该方法是利用与 HLA 等位基因序列互 补的引物,对待测样本 DNA 进行特异性 PCR 扩增。由于每对特异性引物所鉴定的是顺式排列的 HLA 等位基因序列,所以该方法的分辨率高,而且容易鉴定出杂合子。特异性 PCR 扩增产物很容易用琼脂糖凝胶电泳检测,根据特异性 PCR 扩增产物的出现与否,对待测样本的 HLA 等位基因型别进行判断。
用途
序列特异性引物 PCR 可用于 HLA 基因分型,点突变遗传病等的基因诊断。
材料与仪器
器材:PCR 扩增仪
试剂:
① 模板:基因组 DNA 或 cDNA
② dNTP 混合液:每种脱氧核糖核昔酸的浓度为 2.5 mmol/L
③ 引物群:多对 HLA 等位基因特异性的引物,浓度均为 10 umol/L
④ Taq DNA 聚合酶及其 10× PCR 缓冲液
⑤ 高压灭菌去离子水
⑥ 用于琼脂糖凝胶电泳的试剂
步骤
序列特异性引物 PCR 的基本过程可分为如下几步(以外周血样本为例):
(一)外周血 DNA 提取
1、500 ul EDTA 血 (新鲜或冻存) 加入 1 ml 红细胞裂解缓冲液 (0.32 mol/L 蔗糖,1% Triton X-100,5 mmol/L MgCl2,12 mmol/L Tris-Cl,pH 7.5),轻轻颠倒混匀,裂解红细胞,13000 r/min 离心 1 min,用 ddH2O 洗一次,13000 r/min 离心 1 min。
2、用下列成分重悬沉淀:80 ul 5× 蛋白酶 K 缓冲液 ,30 ul 蛋白酶 K(10 mg/ml),20 ul 2% SDS 和 240 ul ddH2O,55 ℃ 消化 10 min。
3、加入 100 ul 6 mol/L NaCl,激烈振荡混匀 15 s,13000 r/min 离心 5 min,沉淀蛋白,在上清中加入 1 ml 负 20 度冰冻乙醇,沉淀 DNA,70% 乙醇洗涤一次,室温放置 5~10 min,使乙醇挥发干净,50 ul ddH2O 溶解 DNA,紫外分光光度计测定 DNA 含量。
(二)引物设计
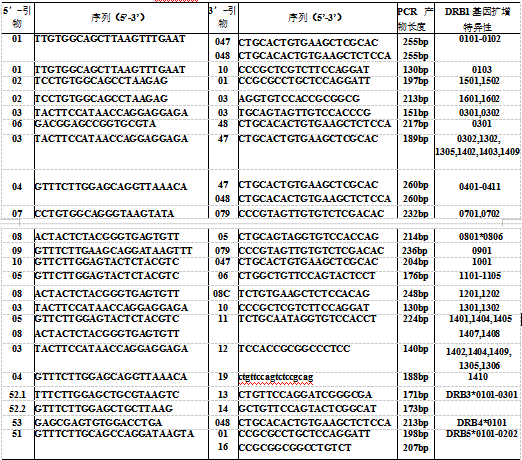
目前 PCR-SSP 的应用主要是 HLA 分型,现将常用的 HLA-DR 的序列特异性引物列于表中。DRB 基因有近 50 个等位基因,表中列出的引物不能将全部等位基因扩增出来,因此称为 HLA-DR 基因中等分辨率分型序列特异性引物。
表 HLA-DR 基因中等分辨率分型的序列特异性引物
(三)SSP 引物混合液的准备
1、预先准备好所有引物的混合液,其中包括除 Taq 聚合酶和同一份待测基因组 DNA 之外的所有 PCR 反应成分,即:
① 2 pmol 5' 末端和 3' 末端的引物(已知配对的一对引物);
② 2 pmol 内参照引物(β-actin 基因引物);
③ 200 umol 各种 dNTP(dATP,dCTP,dGTP,dTTP);
④ 1×PCR 缓冲液,10 mmol/L Tris-Cl,pH 8.3,50 mmol/L KCl,1.5 mmol/L MgCl2,0.01% 明胶;
⑤ Ficoll 400(终浓度为 1%, 体积分数);
⑥ 加样缓冲液(甲酚红,终浓度为 0.01 g/L)。
2、将这些引物混合液准备好后,分装至作好标记的 PCR 扩增管中,每扩增管中引物混 合液的体积为 36 ul,反应体积的调整使用去离子水,不要使用 TE,EDTA 可抑制 Taq 聚合酶的 活性。置于-20 ℃ 保存,临用时取出。
(四)DNA/Taq 聚合酶混合液的准备
1、计算扩增所需管数,每对 SSP 引物需用一只扩增管单独扩增。
2、计算 Tag 聚合酶用量,每扩增管需丁时聚合酶 0.5~0.8 U。
3、计算基因组 DNA 总量,每扩增管需 60 ng 的基因组 DNA。
4、将基因组 DNA 和聚合酶在一定量的稀释液中混匀,即为 DNA/Taq 聚合酶混合液,稀释液为上述 1×PCR 缓冲液。用加样器将基因组 DNA 与 Taq 聚合酶混匀,注意混匀时避免形成气泡,否则容易导致气溶胶状 DNA 的形成,造成污染。
注意事项:
每扩增管所需的基因组 DNA 和 Taq 聚合酶的量应包括在 4 ul 体积的 DNA/Taq 聚合酶混合液中。
(五)PCR-SSP 扩增体系的组成
1、取出装有 SSP 引物混合液的扩增管,加入 4 ul 的 DNA/Taq 聚合酶混合液,注意用加样器将 DNA/Taq 聚合酶混合液加入至引物混合液的底部,每扩增管的反应体积为 40 ul。
注意事项:
基因组 DNA 应完全稀释和混匀,吸取或接触不同扩增管的液体后,注意更换吸头;使用的吸头最好带滤膜。
2、每个扩增管加 20 ul 矿物油,防止 PCR 扩增时水分蒸发。
(六)PCR-SSP 扩增
按下述扩增条件进行 PCR 扩增(适合 Perkin-Elmer 9600 PCR 扩增仪,其它型号的 PCR 扩增仪也可以参考上述扩增条件)。
94 °C 预变性 5 min 循环次数 30 次;
94 °C 变性 20 s 65 °C 延伸 10 min;
65 °C 退火和延伸 60 s。
(七)PCR 产物的检测
1、制备 0.5× 或 1× TBE 制备 20 g/L 琼脂糖凝胶,加入适量的漠化乙锭;琼脂糖凝胶的长度与宽度应该与 PCR 扩增管数量相适应,每一扩增管应有相应的一个电泳泳道,凝胶厚度为 3~5 mm, 一般用三只梳子形成三排加样孔;
2、将 PCR 扩增管从 PCR 扩增仪中取出,用加样器吸取扩增后的反应液,加入相应的加样孔中,用 15 V/cm 电泳 25 min;
3、在紫外灯下或凝胶成像仪上观察电泳结果,注意观察每个泳道中内参照引物的扩增产物和相应 SSP 的扩增产物,并拍照存档。
(八)PCR-SSP 结果分析
1、采用 SSP 进行 PCR 扩增后,相应的 PCR 产物是否出现,是 HLA 分型结果的判断的依据,相应 SSP 扩增产物岀现,表示基因组中存在与特异性引物(即 SSP)互补结合的 DNA 序列,即样本为该 SSP 结合的 HLA 基因阳性。
2、当某种 SSP 引物的扩增管中未出现相应的 PCR 产物时,应注意观察内参照引物是否岀现 PCR 产物。如果该扩增管的内参照引物出现 PCR 产物,而无相应 SSP 扩增产物,说明样本为该 SSP 特异性扩增的 HLA 基因阴性;如果该扩增管中未出现内参照引物的扩增产物,则意味着 PCR 扩增出现问题。
注意事项
① PCR-SSP 技术的原理是基于引物序列与基因组(模板)DNA 的严格互补结合,因此使用的以 Taq 多聚酶应该无 3'-5'外切酶活性,否则外切酶的作用可能修正错配的引物-模板复合物,导致错配延伸,出现假阳性结果。
② 由于每一种 HLA 等位基因均需要一对 SSP 扩增,因此对每一个样本进行 HLA 分型时,均需要进行多个扩增,扩增的数目取决于检测 HLA 等位基因的数目。采用扩增管进行 HLA 分型时特别注意每一扩增管中 SSP 的特异性,应该作好标记,并有规律地排列、放置和加样,避免出现混乱,使分型结果错误。除使用微量扩增管之外,还可以使用 96 孔的 PCR 扩增板,较扩增管方便。
③ 由于 PCR-SSP 技术对污染的 DNA 较为敏感,注意加样时使用带有滤膜的吸头;在吸取含有不同 SSP 和基因组 DNA 的溶液后,一定要更换吸头;用加样器吸取或混匀溶液时避免产生气泡,产生气溶胶状 DNA,造成污染。
④ 对 HLA-I 类基因分型时,需要较长的基因组 DNA 链(约 250 kb)作为模板,因为 HLA-I 类基因与 SSP 进行互补结合的 DNA 序列位于第 1~4 外显子之间。在基因组 DNA 提取时应注意。
常见问题
其他样本的 DNA 步骤?
1、口腔拭子基因组 DNA 提取:
用棉拭子刮取口腔壁细胞,将拭子浸泡于细胞裂解缓冲液中 (10 mmol/L Tris-Cl,pH 7.5 100 mmol/L EDTA,0.5% 酰基肌氨酸钠),丢弃棉拭子后,加入 10 ul 蛋白酶 K(10 mg/ml),1 ml 6mol/L 盐酸胍,300 ul 7.5 mol/L 乙酸铵,55 °C 裂解 2 h 释放 DNA,苯酚-氯仿-异戊醇提取,加入 - 20 °C 冰冻乙醇沉淀 DNA,其后同上述。
2、供体组织 DNA 的快速提取:
取组织 30 mg,研磨充分后,放入 1.5 ml 离心管内加入 400 ul STE 缓冲液 (0.1 mol/L NaCl,10 mmol/L Tris-Cl,pH 8.0,1 mmol/L EDTA),20 ul 1% SDS,20 ul 蛋白酶 K(10 mg/ml),混匀,55 °C 消化 10 min。进行苯酚-氯仿-异戊醇提取,加入-20 ℃ 冰冻乙醇沉淀 DNA,其后同上述。