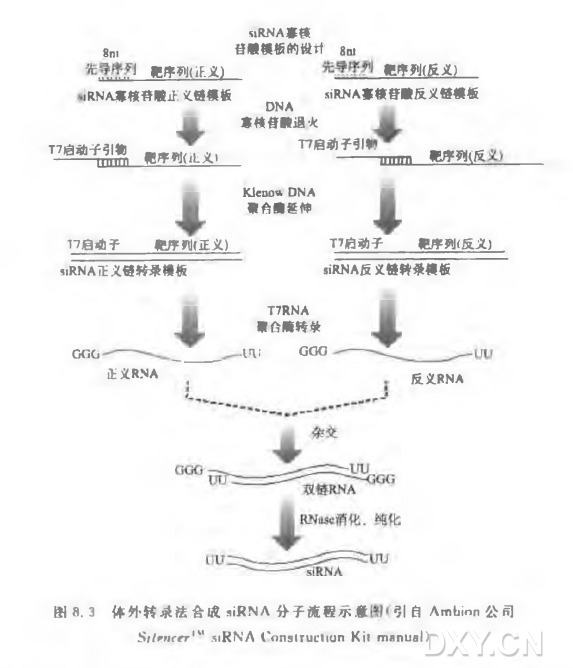
化学合成siRNA分子实验
原理当确定了靶基因上的 siRNA 分子作用位点以后,根据靶位点的序列可以很方便地推导得到相应的 siRNA 分子的正义与反义 RNA 链序列。它们包含 19
原理
当确定了靶基因上的 siRNA 分子作用位点以后,根据靶位点的序列可以很方便地推导得到相应的 siRNA 分子的正义与反义 RNA 链序列。它们包含 19 bp 的互补双链区和两侧的不配对区(每侧为 2 个 U 成 2 个 T ),在合成时用 T 替代 U 可以降低成本并可以提高 siRNA 分子的稳定性,利用 DNA/RNA 合成仪首先分别合成长为 21 nt 的 siRNA 分子的正义链和反义链,然后在体外将它们退火形成双链 siRNA 分子。


材料与仪器
RNA 单链分子
退火缓冲液 核酸转染试剂 DEPC处理水
NuSieve GTG 琼脂糖凝胶
退火缓冲液 核酸转染试剂 DEPC处理水
NuSieve GTG 琼脂糖凝胶
步骤
一、材料与设备
1. 化学合成的正义与反义 RNA 单链分子。
2. 2X 退火缓冲液(200 nmol/L KAc,4 mmol/L MgAc2,60 mmoI/L Hepes-KOH pH 7.4)。
3. NuSieve GTG 琼脂糖凝胶(BMA 公司,www.bmaproducts. com) 。
4. 核酸转染试剂(如 Lipofetamine 2000)。
5. DEPC 处理水。
二、操作方法
1. 用适量经 DEPC 处理的无菌水分别溶解化学合成的正义与反义 siRNA 分子 RNA 链。
2. 在 2X 退火缓冲液中分别加入适量的 DEPC 处理无菌水、正义与反义 RNA 链,使正义与反义 RNA 链的终浓度均为 20 mmol/L。
3. 将上述混合液置 90℃ 变性 1 min,然后置 37°C 温育 1 h,经退火形成的 siRNA 分子可以直接用于转染细胞,或置 -20℃ 保存备用。siRNA 双链复合物可以经过几轮冻融而不受影响,不需要经过再次变性退火处理。但是在处理 siRNA 分子时,建议最好将 RNA 溶液置冰浴中,以降低 RNA 水解的速率。
4. 可以采用 4% 的 NuSieve GTG 琼脂糖凝胶电泳或者 10%~15% 的非变性聚丙烯酰胺凝胶电泳来检验退火的效率。但应注意的是 NuSieve 琼脂糖是一种低溶点琼脂糖,因此在电泳时采用过高的电流时它会熔解。
5. 将 siRNA 双链分子在核酸转染试剂如 Lipofectaminc 2000 的介导下转染靶细胞,并分析它对靶基因的抑制效果。
1. 化学合成的正义与反义 RNA 单链分子。
2. 2X 退火缓冲液(200 nmol/L KAc,4 mmol/L MgAc2,60 mmoI/L Hepes-KOH pH 7.4)。
3. NuSieve GTG 琼脂糖凝胶(BMA 公司,www.bmaproducts. com) 。
4. 核酸转染试剂(如 Lipofetamine 2000)。
5. DEPC 处理水。
二、操作方法
1. 用适量经 DEPC 处理的无菌水分别溶解化学合成的正义与反义 siRNA 分子 RNA 链。
2. 在 2X 退火缓冲液中分别加入适量的 DEPC 处理无菌水、正义与反义 RNA 链,使正义与反义 RNA 链的终浓度均为 20 mmol/L。
3. 将上述混合液置 90℃ 变性 1 min,然后置 37°C 温育 1 h,经退火形成的 siRNA 分子可以直接用于转染细胞,或置 -20℃ 保存备用。siRNA 双链复合物可以经过几轮冻融而不受影响,不需要经过再次变性退火处理。但是在处理 siRNA 分子时,建议最好将 RNA 溶液置冰浴中,以降低 RNA 水解的速率。
4. 可以采用 4% 的 NuSieve GTG 琼脂糖凝胶电泳或者 10%~15% 的非变性聚丙烯酰胺凝胶电泳来检验退火的效率。但应注意的是 NuSieve 琼脂糖是一种低溶点琼脂糖,因此在电泳时采用过高的电流时它会熔解。
5. 将 siRNA 双链分子在核酸转染试剂如 Lipofectaminc 2000 的介导下转染靶细胞,并分析它对靶基因的抑制效果。