β-半乳糖苷酶活性染色方法(SA-β-gal)
原理
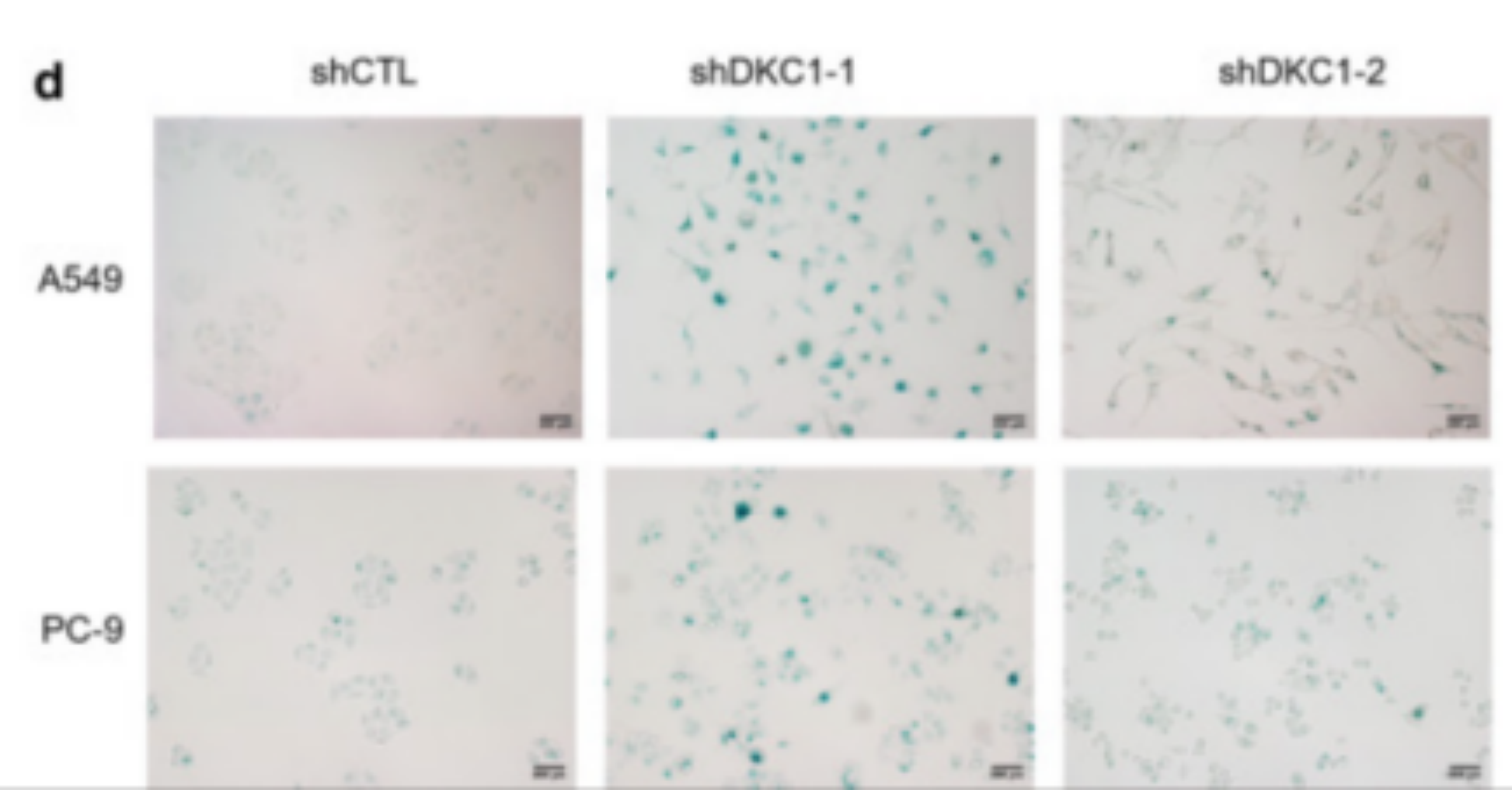
衰老细胞有高活性的 β-半乳糖苷酶(β-galactosidase),通过原位染色,以 X-Gal 为底物,在β-半乳糖苷酶的催化下会生成深蓝色产物,通过光学显微镜即可观察。
用途
组织切片染色或细胞染色,用于检测观察细胞衰老情况。
材料与仪器
β-半乳糖苷酶染色液、X-Gal 溶液、染色固定液、PBS 或 HBSS、1.5 ml 离心管、黑色避光免疫组化湿盒、载玻片、盖玻片、枪头、移液枪、保鲜膜、37 ℃ 培养箱
步骤
组织:
(1)需要染色的组织做冰冻切片,切片复温侯,用 PBS 轻柔洗涤 3 次,每次 5 分钟。
(2)用组化笔圈住组织,加入适当体积的染色固定液固定 30 分钟,体积以充分覆盖组织为宜。
(3)去除染色固定液,用 PBS 洗 3 次,每次 8 分钟。
(4)去除 PBS,每个组织加 30 μl SA-β-gal 染色液,最好正个切片浸泡在染色液中,可用保鲜膜封住防止蒸发,37 ℃ 孵育过夜。
(5)第二天,弃掉工作液,加封片剂封片,光学显微镜下观察拍照。
细胞:
1. 对于贴壁细胞:
(1)对于 6 孔板中培养的细胞,吸除细胞培养液,用 PBS 或 HBSS 洗涤 1 次,加入 1 ml 染色固定液,室温固定 15 分钟。
(2)吸除固定液,用 PBS 或 HBSS 洗涤细胞 3 次,每次 3 分钟。
(3)吸除 PBS 或 HBSS,每孔加入 1 毫升 SA-β-gal 染色液。
(4)37 ℃ 孵育过夜,可以用保鲜膜封住防止染色液蒸发。
(5)普通光学显微镜下观察。如不能及时观察计数,可以去除染色工作液,加入 2 ml PBS,4 ℃ 可以保存数天;或者加上封片液封片后,4 ℃ 可以保存较长时间。
2. 对于悬浮细胞:
(1)离心收集细胞至 1.5 ml 离心管内,用 PBS 或 HBSS 洗涤 1 次,加入 1 ml 染色固定液,室温固定 15 分钟。固定时可以在摇床上缓慢摇动,以避免细胞结成团块。
(2)离心,吸除细胞固定液,用 PBS 或 HBSS 洗涤细胞 3 次,每次 3 分钟。
(3)离心,吸除 PBS 或 HBSS,每管加入 0.5~1 毫升 SA-β-gal 染色液。
(4)37 ℃ 孵育过夜。
(5)取部分染色后的细胞,滴加到载玻片上或孔板内,普通光学显微镜下观察。如不能及时观察计数,可以离心,去除染色工作液,然后加入 1 ml PBS,4 ℃ 可以保存数天。如果离心,取细胞用于涂片,加上封片液封片后,4 ℃ 可以保存较长时间。

注意事项
1. 孵育的持续时间取决于 β-半乳糖苷酶表达的强度。有时它需要超过 2 天的孵育时间。
2. 湿纸巾放入免疫组化避光湿盒中,避免干片。
3. 37 ℃ 孵育不能在二氧化碳培养箱中进行。
4. 孵育染色液时用保鲜膜封住湿盒防止染色液蒸发。
5. 加入染色液后,可能有结晶形成影响观察,可去除染色液后,用 70% 乙醇洗涤,待结晶溶解后换成 PBS,再观察。
6. 建议选择成熟的 β-半乳糖苷酶染色试剂盒。
常见问题
拍出来的片子为什么有大量杂质?
1. 工作液需要完全融化,必要时可在 37 ℃ 烘箱中溶解,现用现配,低温会使工作液再次结晶。
2. 试剂盒可能过期变质。
3. 可用 70% 乙醇轻柔冲洗几次。