细胞表型检测之细胞凋亡(Hoechst染色 + PI染色 + TUNEL 染色 + Annexin V-PI 双染)
文章目录
- 1. 细胞凋亡
- 2. 检测细胞凋亡:Hoechst 染色
- 3. 检测细胞凋亡:PI 染色
- 4. 检测细胞凋亡:TUNEL 染色
5. 检测细胞凋亡:Annexin V-PI 双染
1. 细胞凋亡
细胞要增殖分裂出新细胞需要经过完整的细胞周期,细胞周期中有 2 个关键的 check-point 细胞周期检验点:
△ G1/S check-point:调控细胞从静止状态进入 DNA 合成期,防止有损伤或突变的细胞进入 S 期,并启动相应的信号通路进行损伤修复。
△ G2/M check-point:是决定细胞分裂的控制点。如果能够通过这个检查点,细胞内的染色体就能收缩,开始有丝分裂;如果不能通过,细胞就会暂停,启动 DNA 的损伤修复机制。如果 DNA 损伤修复机制仍然不能修复,细胞就会进入程序化的细胞凋亡路径。
细胞凋亡(Apoptosis)的过程
细胞凋亡:是细胞主动的,有步骤的死亡过程,不涉及炎症。
细胞坏死:被动的,无序的死亡过程。
在压力刺激下(紫外线、氧化剂、烷化剂、药物等),细胞的基因组 DNA 可能会发生损伤,如果损伤能被修复,就能继续行使功能;如果损伤不能被修复,细胞就无法进入正常的细胞周期,就会主动进入细胞凋亡过程。

在细胞凋亡时,细胞核会发生变形、浓缩、碎裂,因此我们可以通过检测细胞核的形态来判断细胞是否凋亡,比如用 Hoechst 染色或 DAPI 染色。
细胞膜也会发生变化,部分膜会包裹细胞的内容物形成凋亡小体,因此我们可以通过电镜观察有没有凋亡小体来判断细胞是不是正在凋亡。
胞膜还会发生的一个变化是破损外翻,这样我们就可以用一些标记细胞膜内侧的染料来检测细胞膜是否外翻,配合检测细胞核内物质的染料进行双染,判断细胞凋亡的程度,比如 Annexin-V/PI 双染。
△ Annexin-V 是细胞膜内侧独有的磷脂酰丝氨酸的特异性染料,对磷脂酰丝氨酸有高度亲和性。
△ PI 不能通过活细胞膜,细胞凋亡时,细胞核内的核酸能被 PI 染色,所以能被 PI 染色标记的细胞就是凋亡得厉害的细胞。
细胞凋亡时还有个显著特征是基因组 DNA 的片段化,可以抽提基因组 DNA 去跑电泳观察是否有规律排列的 DNA ladder。
△ 基因组 DNA 的片段化:细胞凋亡时,核酸内切酶被激活,在核小体与核小体之间切割,将 DNA 切割成大小为 200bp 的整数倍的片段。
DNA 断裂时,DNA 的 3’端断裂口会出现游离的 3’-OH,可使用 TUNNEL 法检测细胞凋亡。(利用脱氧核糖核酸末端转移酶将脱氧核糖核酸和荧光素、过氧化物酶、碱性磷酸酶或生物素标记到 DNA 3’端,正常细胞几乎没有 DNA 断裂,不会被标记,通过观察荧光信号或 DAB 显色后是否有棕黄色的阳性信号,判断细胞是否发生凋亡。)
还有一个利用 DNA 片段化这一特征检测细胞凋亡的方法是 PI 染色。PI 可以染基因组 DNA,细胞凋亡时形成的短片段 DNA 被 PI 染色后,比长片段 DNA 颜色浅,从而区分正常细胞和凋亡细胞。
细胞凋亡是基因严格控制的过程,涉及一些列基因的激活、表达、调控等,这些基因在种属之间是保守的,如 bcl-2 家族、Caspase 家族、癌基因 c-myc、抑癌基因 p53 等,可通过检测相关通路和分子 marker 检测细胞凋亡。
细胞凋亡不仅会发生在细胞出现损伤而无法修复的时候,也会发生在像发育这种正常的生理过程中。它既可以清除那些坏掉的细胞,也可以清除那些虽然没坏,但是机体已经不需要的细胞。
2. 检测细胞凋亡:Hoechst 染色
Hoechst 染色检测细胞凋亡的原理
Hoechst 是一种蓝色荧光染料。
有 3 种类似物,分别是 Hoechst 33258,Hoechst 33342 和 Hoechst 34580。
其中 Hoechst 33258 和 Hoechst 33342 最常用,两者具有相同的激发光谱和发射光谱范围。Hoechst 33342 渗透性更好,更推荐。
Hoechst 能穿过细胞膜与 DNA 双螺旋的小沟结合,尤其是富含 AT 的序列。
DAPI 也是染细胞核的蓝色染料,如果是染固定细胞,两者都可以,如果是染活细胞,建议用 Hoechst,因为 Hoechst 对细胞的毒性比 DAPI 小。
Hoechst 33342 和 Hoechst 33258 都能用 350nm 的紫外光激发,最大发射光 461nm(蓝色)。
正常细胞 基因组 DNA 分布均匀,Hoechst 染色后是比较均匀的蓝色,细胞核是圆圆的。
分裂旺盛的细胞 具有比较大的核仁,在核仁的位置染不上 Hoechst,会出现黑色的空洞,核的边缘比较清晰,且形状比较规则的。
凋亡细胞 由于核固缩、变形、碎裂,Hoechst 染色的核的形状变成月牙状或碎裂成几块,呈现出来的蓝色发白发亮。
适用于检测培养的细胞和组织样本。

Hoechest 染色检测细胞凋亡的操作流程
适用于检测培养的细胞和组织样本。
细胞爬片/切片:将灭菌小圆玻片放入 24 孔板,将合适密度的单细胞悬液加入孔中培养过夜,细胞就能长在玻片上。
石蜡/冰冻切片水化后直接 Hoechst 染色。
◆ 可以检测培养细胞的凋亡,也可以检测组织切片里的细胞是否发生凋亡。
◆ 细胞爬片制备:用浓硫酸和重铬酸钾配制的玻璃清洁液浸泡小圆玻片过夜,腐蚀掉玻片表面的脏东西;用流水冲洗玻片,用丝绸布(蛋白质,不会掉纤维)擦干净玻片;将擦干净的玻片一片片平铺在耐高温的玻璃皿(预先放几张吸水纸)中的吸水纸上,高温高压灭菌烘干;在超净台中用灭菌的镊子把玻片放入 24 孔板。
◆ 加单细胞悬液时控制好量,只加在玻片范围内,防止细胞长到玻片的反面,影响后续观察。
◆ 移动平板时也要端平慢移,等细胞贴牢后再把培养基补足。
PBS 洗:培养过夜的细胞爬片去上清,PBS 洗 3 次,每次 5min。(此步可省略)
固定:细胞爬片加 4% PFA 室温固定 15-20min。如果细胞带 GFP 荧光,想在观察 Hoechst 的同时观察 GFP 荧光,就缩短固定时间到 15min,PFA 固定时间越长,GFP 荧光就越弱。
PBS 洗:弃固定液, PBS 洗 3 次,每次 5min。(洗掉 PFA)
Hoechst 染色:在细胞爬片/切片上滴加 Hoechst 33342 染液(200μg/ml in PBS),室温避光孵育染色 5min 后,吸去染色液,在 PBS 中静息 5min (不要洗太久,以免被 Hoechst 洗掉) 后,封片(用抗荧光淬灭的封片剂封片)。
◆ 小圆玻片封片:准备干净的载玻片,预先在干净的载玻片上滴 2-3ul 封片剂,把小圆玻片上有细胞的一面面向封片剂轻轻靠过去,把爬片封在载玻片上,如果玻片周围有多余的封片剂溢出,用吸水纸把多余的封片剂吸掉,能封得更牢些。小圆玻片在 24 孔板中单独用镊子不好取出,可以用一次性的针头一手轻轻撬玻片,一手用镊子夹住。
荧光显微镜拍照:UV 激发下观察和拍照。
◆ 如果封片后要用油镜,为了避免片子移动,需要用指甲油封边;或想过两天再拍照,也需要用指甲油封边,以免封片剂干掉。
◆ 制备好的样品暂时不拍照需要在 4℃避光保存。
推荐:
Hoechst 33342, Sigma B2261
VECTASHIELD Mounting Medium, Vectorlab, H1000 抗荧光淬灭的封片剂。货号 H1200 的是带 DAPI 的,不建议用因为本实验中已经用 Hoechst 染了蓝色,不需要再用 DAPI 染色,且单独染的 DAPI 比封片剂自带的 DAPI 染的更好看。
Hoechst 染色检测细胞凋亡实验分组设计

数据处理与绘图
定性分析:

A:正常细胞,胞核呈光滑圆形,胞核染色较均一。(黑色的空洞是核仁,核仁较大,分裂旺盛)
B:凋亡细胞,胞核碎片化,因 DNA 浓缩致密而深染(蓝色发白)。
C:坏死细胞,胞核边缘不清晰,DNA 不浓缩。
D:正在分裂的细胞,因 DNA 浓缩致密而深染(蓝色发白),但明显可见两组 DNA 分列两排。
定量分析:
每组都随机多拍几个视野,或全片扫描,计数总细胞数和凋亡细胞数,计算比例。将 3 次独立重复的数据都分析完后进行统计分析并绘制柱状图。
3. 检测细胞凋亡:PI 染色
PI 染色检测细胞凋亡的原理

PI (propidium iodide),碘化丙啶,是一种核酸染料,既能染 DNA,也能染 RNA,能发出红色荧光。
PI 不能通过细胞膜完整的细胞 (如活细胞和早期凋亡细胞) 。
需要先将 RNA 去除以排除 RNA 的干扰。
正常细胞的 DNA 是完整的,PI 能将这些细胞深染,而凋亡细胞中 DNA 是断裂成一段一段的,PI 也能结合上去,但是染色没那么深。
参考:PI 染色法检测细胞周期
PI 染色检测细胞增殖的操作流程
适用于检测培养的细胞,不适用于检测组织样本。
消化收集细胞:收集 细胞培养上清(可能是凋亡的细胞)和贴壁细胞,用含 EDTA 的 0.25%胰酶消化细胞呈单细胞悬液,DMEM+10%FBS 终止消化后,将单细胞悬液加入 2ml 圆底离心管中,1500rpm 离心 5min 沉淀细胞,弃上清。
PBS 洗:加入 1ml 预冷的 PBS 重悬细胞沉淀, 1500rpm 离心 5min,弃上清,以充分去除残留的 FBS 和胰酶。
固定:加入 2ml -20℃预冷的 70%乙醇重悬细胞沉淀(加乙醇时应注意边加入边轻柔吹起细胞,放置固定时细胞结成团,难以吹散而影响后续的检测),4℃固定 30min 或 -20 ℃固定过夜后, 1500rpm 离心 5min,弃上清,去除残留的乙醇。
PBS 洗:加入 1ml 预冷的 PBS 重悬细胞沉淀, 1500rpm 离心 5min,弃上清后, 500ul PBS 重悬细胞。
RNA 去除:加入 RNase A(工作浓度 20μg/ml),37 ℃孵育 30min,充分降解细胞内 RNA,后 1500rpm 离心 5min,弃上清。
PI 染色:500μl PBS 重悬细胞沉淀,加入 25ul PI 染液(工作浓度 50μg/ml),冰上放置避光孵育染色 30min。
PI 推荐: eBioscience 00-6990 (按说明书 5μl PI 加入 100μl 细胞)
流式细胞仪检测:染色后的细胞过 300 目筛,置流式管中上流式细胞仪检测,如果暂时不能检测 4 ℃ 冰箱保存待测。
PI 染色检测细胞周期实验分组设计

除了空白对照、阴性对照、实验组,还需要准备未染色的空白细胞,用于流式细胞仪检测时调背景参数等。
独立重复做 3 次。
数据处理与绘图
使用专用软件分析流式数据(可以使用 FlowJo),得到得到 Sub G0 比例。
将 3 次独立重复的数据都分析完后进行统计分析并绘制柱状图。
A:正常细胞,无 Sub G0 峰。
B:凋亡细胞,因 DNA 片段化,有明显的 Sub G0 峰。

参考:
FlowJo 流式数据分析基础——常见术语
Flowjo 分析细胞功能实验数据
4. 检测细胞凋亡:TUNEL 染色
TUNEL 染色检测细胞凋亡的原理
TUNEL(Terminal deoxynucleotidyl transferase dUTP Nick-End Labeling,脱氧核苷酸末端转移酶 TdT 介导的 dUTP 缺口末端标记)
TUNEL 法要素:TdT 酶、dUTP、DNA 缺口标记。
◆ TdT 酶:末端脱氧核苷酸转移酶,是一种不需要模板的 DNA 聚合酶,可以往 DNA 上加碱基,可以催化脱氧核苷酸结合到分子的 3’-OH 端,带有凸出、凹陷、或平滑末端的单双链 DNA 分子都可以作为 TdT 的底物。
◆ dUTP:2’-脱氧-5’-三磷酸尿苷,在 PCR 和 rtPCR 反应中可以替代 dTTP,从而防止扩增的干扰,导致产物中含有尿嘧啶。
△ 使用 dUTP 的 TUNEL 法是基础版,plus 版用 BrdU、EdU 替代 dUTP,因为 BrdU、EdU 插入 DNA 的效率比 dUTP 高,且 BrdU、EdU 有抗体,可以再用抗体检测 BrdU、EdU。
◆ DNA 缺口标记:即检测到的阳性信号应该是位于 DNA 缺口处的。
正常细胞基因组断裂很少,细胞凋亡时,DNA 内切酶激活,切断核小体间的基因组 DNA,断裂造成的缺口处会出现很多暴露的 3’-OH。
TdT 酶可将标记的 dUTP 加到暴露的 3’-OH,根据标记可以进行后续观察。FITC 绿色荧光标记的 dUTP 通过荧光显微镜或流式细胞仪检测,生物素标记的 dUTP 用 DAB 显色后通过显微镜检测。

TUNEL 法一旦检测到细胞凋亡,就说明细胞已经到凋亡晚期了,因为细胞凋亡晚期时 DNA 才被切成一段一段的,早期不容易检测到。
TUNEL 染色检测细胞凋亡的操作流程
适用于检测培养的细胞爬片、悬浮细胞的甩片或涂片、石蜡组织切片或冰冻切片样本。
样本不同,处理方式有所不同:

样品准备:
细胞爬片:将灭菌玻片放入 24 孔板,单细胞悬液加入孔中培养过夜。
石蜡/冰冻切片:脱蜡水化。
PBS 洗: 细胞爬片准备好后 PBS 洗 1 次, 5min。 (如果细胞贴得不牢,可以干燥样品,使细胞贴得更牢,或省略此步直接固定)
固定:贴壁细胞或细胞涂片用 4%PFA 室温固定 30min;冰冻切片用 4%PFA 室温固定 30-60min(不要使用酸性固定液,容易导致出现假阳性;不要使用乙醇或甲醇固定,会导致后面 TUNEL 标记效率降低) ;石蜡切片可短暂固定 5min(脱蜡水化后如果怕片子掉,或后续操作步骤多,片子变得乱糟糟不好看,可以再用 4%PFA 做后固定 5min) 。
◆ 无论是什么样品,固定一定要迅速且充分,因为有的组织核酸酶活性比较高,容易出现假阳性。 固定时间不宜过长,会导致蛋白和 DNA 交联在一起,降低 TUNEL 标记效率。
PBS 洗:弃固定液, PBS 洗 3 次,每次 5min。(冰冻切片洗 2 次)
透化:细胞用 0.3% Triton X-100,室温孵育 5min 透化;冰冻切片用 0.5% Triton X-100,5min;石蜡切片使用 20μg/ml 不含 DNA 酶的蛋白酶 k 处理,20-37℃作用 20-30min,不同组织的最佳温度和时间需摸索。
PBS 洗:弃透化液, PBS 洗 3 次,每次 5min。(可以多洗几次,必须把蛋白酶 K 洗干净,因为后面是用酶标记的,不洗干净会严重干扰后续标记反应)
◆ 如果 dUTP 是用生物素标记的,后面用 DAB 显色,那所有类型样品都要加内源性过氧化物酶封闭,用 PBS 配制 0.5%H2O2室温封闭 20min,封闭后再用 TdT 配套的 Buffer 配制的 0.05%BSA 室温封闭 10min。
TUNEL 反应:用 TdT 配套的 Buffer 配制的 TUNEL 检测液(含 200U/ml TdT)和 2-4μM dUTP 滴加到细胞爬片或组织切片样品上,37℃避光孵育 60min(如果是生物素标记的 dUTP 不用避光),注意防 TUNEL 检测液蒸发(可以将实验室常备的封口膜剪成合适大小的长条或圆片,覆盖在样品上,同时可以使 TUNEL 检测液均匀覆盖到样品;也可以用阻水笔圈出一个区域进行染色,反应在湿盒中进行)。
PBS 洗:弃反应液,PBS 洗 3 次,每次 5min,抗荧光淬灭封片剂封片。
◆ 也可以用 DAPI 双染,有些细胞是不凋亡的,就只会被 DAPI 染色;凋亡的细胞会被 TUNEL 和 DAPI 染色。
◆ 悬浮细胞或细胞悬液透化之后,用 PBS 洗 2 次,加入 50ul TUNEL 检测液,37℃避光孵育 60min,PBS 洗 2 次,再用 PBS 重悬后用流式细胞仪检测,或涂片后用荧光显微镜观察。
荧光显微镜检测:观察和拍照。
FITC:激发光波长 450-500nm,发射波长 515-565nm。
TUNEL 染色检测细胞凋亡实验分组设计

有些试剂盒带有阳性对照,用阳性对照试剂处理细胞,正常细胞就会发生严重凋亡。
细胞转染或药物处理前,对细胞进行同步化,每个样本至少重复 3 次。
数据处理与绘图
定性分析:选典型视野拍照。
定量分析:每组多拍几个视野或全片扫描,计数总细胞数和凋亡细胞数,计算比例。将 3 次独立重复的数据都分析完后进行统计分析并绘制柱状图。
◆ 计总细胞数,如果是用荧光标记的,就做 DAPI 染色,把所有细胞的细胞核都染上;如果是用 DAB 显色的,可以用苏木精染细胞核。
5. 检测细胞凋亡:Annexin V-PI 双染
Annexin V-PI 染色检测细胞凋亡的原理

Annexin V-PI 法要素:Annexin V、PI、细胞膜不对称性破坏。
△ Annexin-V 是细胞膜内侧独有的磷脂酰丝氨酸的特异性染料,对磷脂酰丝氨酸有高度亲和性。
△ PI 不能通过活细胞膜,细胞凋亡时,细胞核内的核酸能被 PI 染色,所以能被 PI 染色标记的细胞就是凋亡得厉害的细胞。
正常细胞的细胞膜中,磷脂酰丝氨酸位于细胞膜磷脂双分子层的内层。
凋亡细胞中,磷脂酰丝氨酸位于细胞膜磷脂双分子层的外层。Annexin V 能以钙依赖的方式结合凋亡细胞膜外层的磷脂酰丝氨酸。
根据 Annexin V-PI 双染结果,可以判断细胞是否发生凋亡,以及凋亡程度如何。
Annexin V-PI 染色检测细胞凋亡的操作流程 (简化)
适用于检测培养的细胞(悬浮细胞、贴壁细胞),不适用于检测组织样本。
制备细胞悬液:用不含 EDTA 的胰酶 37℃ 孵育消化细胞,制备细胞悬液, 2000rpm 离心 5min(为了下一步重悬容易点,离心速度可以减慢成 1500rpm,或离心时间可以缩短成 3min,看情况调整),弃上清。
◆ 消化贴壁细胞注意:
① 培养上清中的细胞很可能是凋亡的细胞,也要收集,消化液中的细胞也要收集。
② 所用的胰酶不能含有 EDTA,因为 EDTA 可以螯合钙离子,而 Annexin V 与磷脂酰丝氨酸的结合是钙依赖的。
洗 2 次:用 PBS 将细胞轻轻重悬洗一次,2000rpm 离心 5min,再用 1×binding buffer 重悬洗涤,2000rpm 离心 5min,弃上清。
◆ 配制 1×binding buffer:Annexin V 通常会配一支 10×binding buffer,趁胰酶消化细胞时,用无菌去离子水稀释成 1×binding buffer(现配现用)。
调整细胞浓度:使用 1×binding buffer 重悬细胞,将细胞浓度调整为 1-5×106 /ml。(用细胞计数板计数后调整,60mm 的皿,细胞单层生长,长到 90%时大概可以得到 5×106 个细胞,具体看培养的细胞大小和培养密度)
Annexin V 染色 :取 100ul 细胞悬液,加入 5ul 荧光标记的 Annexin V (按试剂说明书加染料),室温避光孵育 10-15min。
洗: 1×binding buffer 洗一次,2000rpm 离心 5min,200μl 1×binding buffer 重悬细胞。
PI 染色:加入 5μl PI,混匀,PI 染色很快,加完就可以上机检测。
流式测定。
试剂:
PI, eBioscience 00-6990
Annexin V-FITC Apoptosis Detection Kit, eBioscience BMS500FI
Annexin V Apoptosis Detection Kit APC, eBioscience 88-8007
Annexin V-PI 染色检测细胞凋亡实验分组设计

除了空白对照、阴性对照和实验组,还需要设置两管单染组。
最好再多加一组未染色的组,方便寻找目标细胞群。
数据处理与绘图
定量分析:使用专用软件分析流式数据(可以使用 FlowJo),得到凋亡细胞比例。将 3 次独立重复的数据都分析完后进行统计分析并绘制柱状图。
Annexin V/PI 染色检测细胞凋亡实验如何读图?

正常细胞:Annexin V 阴性,PI 阴性;
早期凋亡细胞:Annexin V 阳性(早期晚期都能检测到),PI 阴性(早期细胞膜还比较完整);
晚期凋亡细胞:Annexin V 阳性,PI 阳性;(双阳性)
细胞碎片:Annexin V 阴性(膜没有了),PI 阳性。

Jurkat cells 白血病悬浮细胞
anti-Fas antibody 诱导细胞凋亡
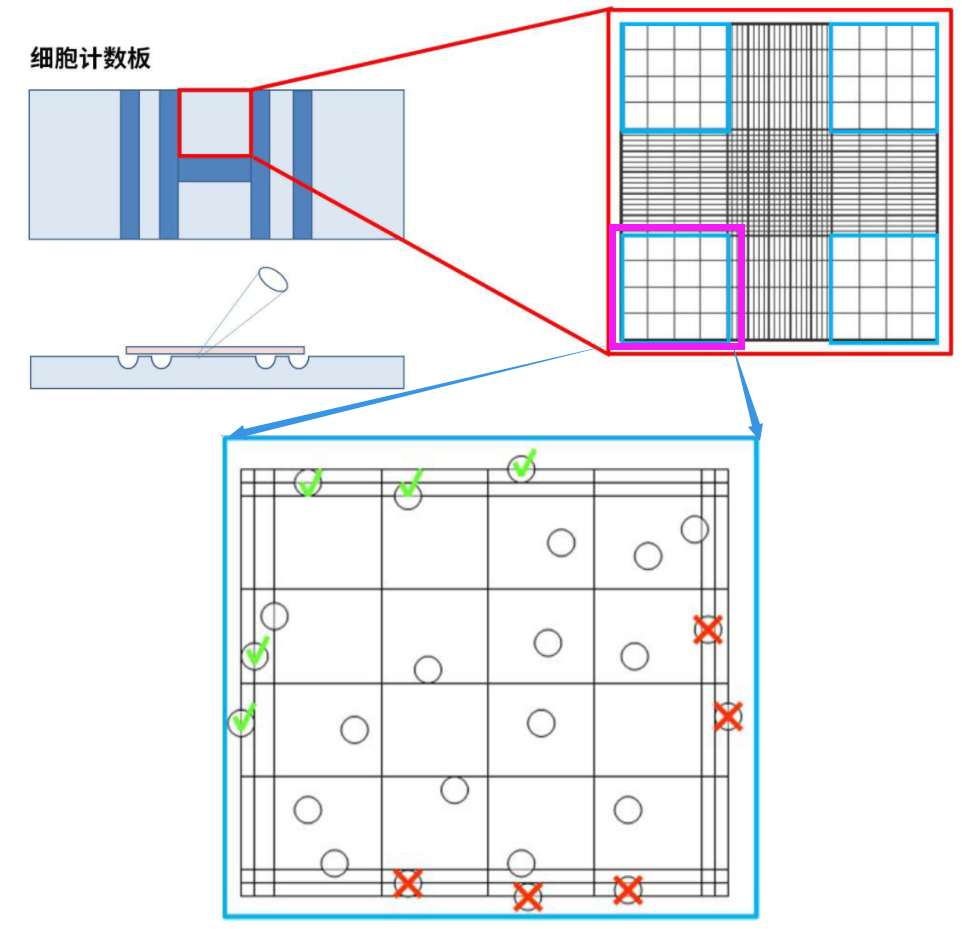
细胞计数(细胞计数板):
计数原则:压线细胞-数上不数下,数左不数右,如下图所示。
计算公式:4 个大方格中的细胞数 ÷ ÷÷ 4 × ×× 稀释倍数 × ×× 104 = 细胞个数/ml
◆ 稀释倍数:例如,60mm的皿,细胞长到90%,消化成2ml细胞悬液,取100ul,稀释到1ml。