长片段 PCR 实验
简介
常规 PCR 反应可以扩增到 3~4 kb 的 DNA 片段,而超过 5 kb 的 DNA 片段就已经很难扩增出来了。虽然有人可以扩增出 5~15 kb 的 DNA 片段,但产量很低。造成常规 PCR 扩增长片段 DNA 效果不好的原因有以下几点:
① 常规 PCR 反应中应用的耐热 DNA 聚合酶(如酶)缺乏 3'→5' 核酸外切酶活性,不具备很好的校读功能,因而具有较高频率的错误碱基的掺入,不能有效扩增长片段 DNA;
② 较长的模板 DNA 容易形成高级结构,使 DNA 聚合酶难以与模板结合,也就实现不了扩增。
原理
长片段 PCR 实验的基本原理是用两种 DNA 聚合酶进行反应,一种是用常规 PCR 反应中应用的耐热 DNA 聚合酶(常用 Taq 酶),它具有很强的延伸能力,依赖此酶进行链的延伸。另一种是具有 3'→5' 核酸外切酶活性的耐热 DNA 聚合酶(常用 Pfu 酶),它具有较好的校读功能,可以将错配的碱基切割下来重新利用第一种酶进行链的延伸。两种酶各有优缺点,充分利用第一种酶的延伸能力和第二种酶的校读功能,使两种酶在反应中相辅相成,完成长片段 DNA 的扩增。
材料与仪器
器材:PCR 仪、移液器;
试剂:
① 10 × PCR 缓冲液【500 mmol/L Tris-Cl(pH9.0),160 mmol/L 硫酸铵,25 mmol/L MgCl2,1.5 mg/ml 牛血清白蛋白】;
② dNTPs:20 mmol/L,pH8.0;
③ 正向引物:20 μmol/L;
④ 反向引物:20 μmol/L;
⑤ 热稳定 DNA 聚合酶混合液:0.187 U Pfu(Stratagene)和 33.7 U Klentaql(AB Peptides);
⑥ TE 缓冲液:10 mmol/L Tris-HCl(pH8.0),1 mmol/L Na2EDTA;
⑦ 10 × TBE 缓冲液:90 mmol/L Tris,89 mmol/L 硼酸(pH8.3),2.5 mmol/L EDTA;
⑧ 琼脂糖凝胶电泳试剂;
耗材:0.5 ml 离心管、和微量加样器的 tip。
步骤
长片段 PCR 实验的基本过程可分为如下几步:
A、引物设计
引物设计的原则应遵守常规 PCR 引物设计原则,即避免形成二级结构及引物二聚体等。另外,在长片段 PCR 中引物 3' 末端核昔酸的特异性对长片段扩增尤为重要,应与模板严格配对,且要注意两引物的 3' 末端不能互补。
引物长度通常比常规 PCR 的引物稍长些,在 30~35 个碱基,过长不会增加扩增的效率,过短会减少扩增的特异性。两条引物的解链温度趋向相等是尤其重要的。如果两条引物的解链温度超过 1 ℃,可能会造成错误引导以及一条链的优势扩增等问题。
用于长片段 PCR 的引物用全自动 DNA 合成仪合成后,一般不需要进一步纯化。然而,如果寡核苷酸引物经商品化的树脂进行柱层析纯化或者经变性的聚丙烯酰胺凝胶电泳纯化,纯化后的引物用于扩增低丰度的 mRNA 时常常会更有效。
B、模板的制备
长片段 PCR 对于多种类型的模板都能有效扩增,例如重组 BAC、PAC、黏粒、A 噬菌体克 隆、高分子量基因组 DNA 和由 RNA 反转录得到的 cDNA0 DNA 模板的平均长度至少应该是预 期的 PCR 扩增产物长度的 3 倍以上。模板 DNA 应该尽可能有较高的纯度。作为长片段 PCR 的 DNA 模板的纯化制备,最好的方法是使用超速离心机进行 CsCl 平衡密度梯度离心,然后用 TE (pH8.0)缓冲液进行透析。也可用磁珠吸附长片段的 DNA 得到较纯的模板。已被轻微损伤的模板,应用大肠杆菌核酸外切酶 m 处理,能够部分消除损伤模板对扩增反应的影响,可大大提高扩增效果。
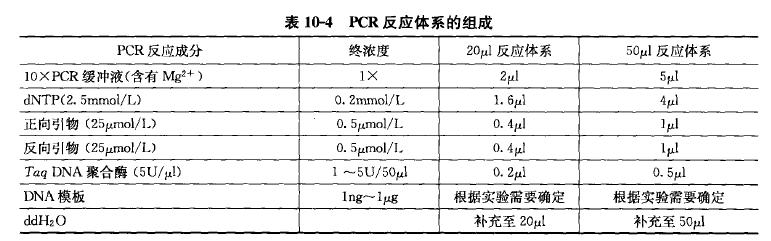
C、反应体系
按下列次序将各种试剂加入到 0.5 ml 的离心管中:
① 5 μL 10 X PCR 缓冲液;
② 5 μL 20 mmol/L 4 种 dNTP 混合液;
③ 1 μL 20 μmol/L 正向引物;
④ 1 μL 20 μmol/L 反向引物;
⑤ 0.2 μL 热稳定 DNA 聚合酶混合液;
⑥ 100 pg~300 ng DNA 模板。
加 HQ 补足至 50 μL
如果 PCR 仪没有配置加热盖,PCR 反应混合液的上层加入矿物油或石蜡油约 80 μL,以防止液体挥发。PCR 反应结束后,可以用 150 μL 氯仿抽提去除。
D 反应参数
93~94 ℃ 2 min;
92~97 ℃ 15 s~1 min;
60~67 ℃ 1 min;
68 ℃ 5~20 min;
25~30 循环;
68 ℃ 7 min。
一般来讲,常规三阶段热循环法可以实现长片段的扩增。但是,如果引物大于 30 个碱基,退火温度在 65~70 ℃ 之间,釆用两阶段热循环法扩增效果更好。
复性温度的设置依赖于寡核昔酸引物的熔解温度(即解链温度)。因为用于长片段 PCR 的引物长度一般是 27~30 bp,因此用于长片段 PCR 引物的熔解温度比一般 PCR 引物的熔解温度高。聚合反应的时间应根据靶基因的长度按每分钟聚合 1 000 bp 的速率来确定。
聚合时间过于延长不能改善扩增产物的特异性或产量。变性的温度和时间是影响长片段扩增非常重要的因素,高温可以损伤模板 DNA,使得 DNA 聚合酶终止合成。减少模板损伤常采用的方法是:釆用尽量低的变性温度及尽量短的变性时间。
延伸时间根据扩增片断的长度和所选用酶的特点而定,时间不能过长,以免形成非特异扩增。后期反应中每次循环递增延伸时间的办法有利于长片段的扩增。热启动可以减少非特异扩增。对于难于优化的模板来说,用每循环降低退火温度的降落 PCR(touch down PCR)方法,以实现对反应条件的自动调试,有时会得到理想的扩增结果。
E、扩增产物的检测
目前最常用的检测方法是用琼脂糖凝胶电泳再以适当大小的 DNA Marker 来分析扩增结果。在许多情况下,扩增产物太少以至于用常规的漠化乙锭染色不能检测到目的条带。在这种情况下,用 SYBR 金颗粒对凝胶上的 DNA 样品进行染色或转移凝胶上的 DNA 样品到尼龙或硝酸纤维素滤膜上用探针进行 Southern 杂交予以确证。
注意事项
1、对于不同来源的模板 DNA,要进行具有针对性的严格优化。在某些情况下,一些非特异片段会干扰长片段 PCR 扩增,可以减少酶量和降低盐浓度来增加 PCR 产物的特异性。对于有些模板,其二级结构过于复杂或不易得到较高的浓度,一次性实现长片段扩增非常困难。釆用融合 PCR 方法就简单多了。
先分段扩出、相互部分重叠、然后将覆盖整个长片断基因组的两段或几段 PCR 产物进行融合反应,以形成全长 DNA,再以此为模板进行长片段 PCR,可以成功实现长片断的扩增。模板 DNA 的用量在 l00 pg~2 μg 之间,模板量太少,扩增产物往往检测不到,模板量太多,扩增产物的特异性显著降低。最好是针对模板 DNA 进行预试验,以确定最佳模板量。
某些轻微损伤的模板用核酸外切酶 Ⅲ 处理的原因是因为核酸外切酶 Ⅲ 除了具有 3'→5' 外切酶活性外,还具有对无嗦吟、无嚅嚏碱基的 DNA 部位显示特异性内切酶活性,对 3' 末端无羟基的 DNA 显示了 3' 磷酸酶活性以及 RNaseH 活性,降解有缺口的 DNA,保证了模 板的完整性。
2、100 mmol/L KCl 可以替代 10 × PCR 缓冲液中的硫酸镂。小牛血清白蛋白可以被多种其它添加剂所替代。这些添加剂的理论作用模式及作用的最终浓度见表 10-2。

这些添加剂能够促进长片段的扩增,可能是通过增加聚合酶的稳定性、降低解链温度以及减少模板链损伤而发挥作用。因为在高温情况下长片段 DNA 模板极易发生脱嗦吟作用和脱氨基作用,甘油和二甲基亚砚等添加剂可以有效地减缓变性的温度和时间,最小程度地减少 DNA 的损伤。并且在某些情况下,同时添加几种添加剂比只加入一种更有效。添加剂浓度过高时会抑制酶的活性,因此也要对其应用浓度进行优化。
3、在低 pH 值的环境下,长片段模板 DNA 容易发生脱噤吟作用而受到损伤,因此,缓冲液最好釆用比 Tris-HCl 的缓冲能力更强的三(羟甲基)甘氨酸(tricine),这样 pH 值才会在高温 环境中变化较小,减少对模板 DNA 的损伤。
4、Mg2+ 浓度一般要比常规 PCR 反应中的浓度高,约在 2~6 mmol/L。Mg2+ 是 DNA 聚合酶 活性依赖因子,不仅影响聚合酶的活性和忠实性,也会影响引物的退火、产物的特异性和二聚体 的形成等。Mg2+ 浓度过低会影响到酶的活性,过高则会降低酶的忠实性和引起非特异扩增。但是目前在长片段 PCR 反应中,还没有确定一个最佳的 Mg2+ 浓度。通常解决的方法是,在能够保证扩增产率及特异性的前提下,选用尽可能低的 Mg2+ 浓度,以最大限度提高聚合酶的保真性。
5、在长片段 PCR 反应中,聚合酶的保真性至关重要。要根据各种 DNA 聚合酶的特性选择用酶。各种 DNA 聚合酶的特点、要求条件以及特性评价见表 10-3。

6、长片段 PCR 反应用管应该使用薄壁管,反应体积也不宜过大,以免影响热传导效率。不同的 PCR 仪对反应也有影响,相同的扩增条件在不同的热循环仪上会得到不同的实验结果,可能是由不同 PCR 仪温度升降的速率不同所致。
7、PCR 仪可以是 Perkin-Elmer9600 或 9 700,也可以是 Eppendorf 公司的 Master cycler,也可以是 MJ Research 公司的 PTC100。
8、一般来讲,常规三阶段热循环法可以实现长片段的扩增。但是,如果引物大于 30 个碱基,退火温度在 65~70 ℃ 之间,釆用两阶段热循环法扩增效果更好。复性温度的设置依赖于寡核苷酸引物的熔解温度(即解链温度)。因为用于长片段 PCR 的引物长度一般是 27~30 bp,因此用于长片段 PCR 引物的熔解温度比一般 PCR 引物的熔解温度高。聚合反应的时间应根据靶基因的长度按每分钟聚合 1 000 bp 的速率来确定。聚合时间过于延长不能改善扩增产物的特异性或产量。变性的温度和时间是影响长片段扩增非常重要的因素,高温可以损伤模板 DNA,使得 DNA 聚合酶终止合成。
9、减少模板损伤常采用的方法是:釆用尽量低的变性温度及尽量短的变性时间。延伸时间根据扩增片断的长度和所选用酶的特点而定,时间不能过长,以免形成非特异扩增。后期反应中每次循环递增延伸时间的办法有利于长片段的扩增。热启动可以减少非特异扩增。对于难于优化的模板来说,用每循环降低退火温度的降落 PCR(touch down PCR)方法,以实现对反应条件的自动调试,有时会得到理想的扩增结果。
相关文章
- PCR-SSCP的发展现状
- PCR-SSCP注意的事项
- PCR-SSCP原理和操作步骤
- 内切酶在PCR反应产物中的活性(Activity of Restriction Enzymes in a Primer Extensio
- RT-PCR Analysis--详细的RT-PCR方法
- RT-PCR: The Basics
- Real-Time or Kinetic PCR
- PCR Amplification from Microbial Colonies
- Calculating Concentrations for PCR
- PURIFICATION OF PCR PRODUCTS WITH SEPHAD